Contenidos
- Acido Ascorbico .com
- Vitamina C
- Escorbuto
- Usos del ácido ascórbico
- Química del ácido ascórbico
- Síntesis del ácido ascórbico
- Datos químicos del ácido ascórbico
- Mecanismo antioxidante del ácido ascórbico
- Ácido ascórbico en cosmética
- Ácido ascórbico en el embarazo y la lactancia
- Ácido ascórbico en la orina (vitamina C)
- Acido eritorbico
- Ascorbatos minerales
- Artículos científicos sobre el ácido ascórbico
- Bibliografía sobre el ácido ascórbico
Otros sitios
El cáncer y sus síntomas
Transaminasas
Ciclo del carbono
Ciclo de Krebs
Eritropoyetina
Antihistamínico
Química del ácido ascórbico
Fórmula, estructura, oxidación, reductonas, determinación, degradación.
ESTRUCTURA DEL ÁCIDO ASCÓRBICO
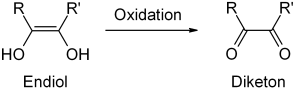
El ácido ascórbico (vitamina C) contiene varios elementos estructurales que contribuyen a su comportamiento químico: la estructura de la lactona y dos grupos hidroxilos enólicos, así como un grupo alcohol primario y secundario. La estructura endiol motiva sus cualidades antioxidantes, ya que los endioles pueden ser oxidados fácilmente a dicetonas.
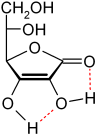
ACIDEZ DEL ÁCIDO ASCÓRBICO
El ácido ascórbico se comporta como un ácido carboxílico vinílogo, en donde el doble enlace ("vinilo") transmite pares de electrones entre el hidroxilo y el carbonilo. Hay dos estructuras de resonancia para la forma desprotonada, que se diferencia en la posición del doble enlace.
Otro modo de ver el ácido ascórbico es considerarlo como un enol. La forma desprotonada es un enolato, que por lo general es fuertemente básico. Sin embargo, el doble enlace adyacente estabiliza la forma desprotonada.
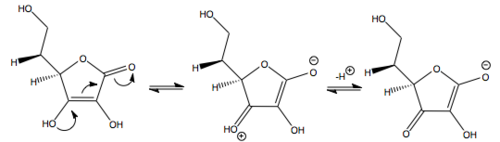
Movimiento de los pares de electrones en la desprotonación
TAUTOMERISMO DEL ÁCIDO ASCÓRBICO
El ácido ascórbico se interconvierte rápidamente en dos tautómeros de dicetona inestables por la transferencia de protón, aunque es el más estable en la forma de enol. El protón del enol se pierde, y se adquiere de nuevo por los electrones a partir del doble enlace, para producir una dicetona. Esta es una reacción enol. Hay dos formas posibles: 1,2-dicetona y 1,3-dicetona.
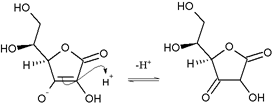
Ataque nucleofílico del enol ascórbico sobre el protón para dar 1,3-dicetona
DETERMINACIÓN DEL ÁCIDO ASCÓRBICO
La concentración de una solución de ácido ascórbico puede ser determinada de varias formas, aunque la más común es la titulación con un agente que se oxida.
DCPIP
Yodo
Otro método implica usar el yodo y un indicador de almidón, en donde el yodo reacciona con el ácido ascórbico, y, cuando todo el ácido ascórbico ha reaccionado, el yodo queda entonces en exceso, formando un complejo azul oscuro con el indicador de almidón. Esto indica el punto final de la titulación.
Como alternativa, el ácido ascórbico puede reaccionar con el yodo en exceso, seguido de una titulación con tiosulfato de sodio usando almidón como indicador.
Yodato y yodo
El susodicho método que implica el yodo requiere componer y estandarizar la solución de yodo. Una forma de hacer esto es generar el yodo en presencia del ácido ascórbico por la reacción del yodato y del ión yoduro en la solución ácida.
N-Bromosuccinimida
Un agente de oxidación mucho menos común es la N-bromosuccinimida (NBS). En esta titulación, la NBS oxida el ácido ascórbico (en presencia de yoduro potásico y almidón). Cuando la NBS está en exceso (es decir, la reacción está completa) libera el yodo del yoduro potásico, que forma entonces un complejo azul/negro con el almidón, indicando el punto del final de la titulación.
ESTEREOQUÍMICA DEL ÁCIDO ASCÓRBICO
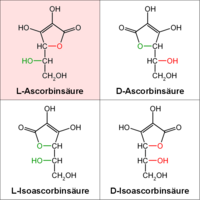
* Ácido L-ascórbico.
* Ácido L-isoascórbico.
* Ácido D-isoascórbico.
Las moléculas L-y D- de ácido ascórbico son enantiómeros entre sí; de igual forma, las L- y D- del isoascórbico.
El ácido L-ascórbico y el D-isoascórbico son epímeros, ya que se distinguen solo en la configuración de uno de los átomos de carbono. A pesar de estas pequeñas diferencias, los estereoisómeros del ácido ascórbico son inactivos en el organismo, dado que las enzimas reconocen específicamente al L-ascórbico. El D-isoascórbico solo presenta un pequeño efecto.